Es ist schon eine ganze Weile her, seit sich das Gesundheitswesen auf eine ermächtigende digitale Reise begeben hat. Angetrieben vom Verbraucherverhalten und stetigen technologischen Fortschritten – und trotz Gesetzeslücken und den damit verbundenen Herausforderungen und Bedenken – revolutioniert und optimiert Software weiterhin die Gesundheitsversorgung. Auch wenn der Begriff SaMD vielleicht nicht allzu bekannt vorkommt, gehört diese Art von Software mehr als wir denken zu unserem Alltag. Wenn Sie von verifizierten mobilen Apps gehört oder sogar verwendet haben, die Insulindosierungen in Abhängigkeit von den Ernährungsprotokollen des Patienten, Fruchtbarkeits-Apps oder Echtzeit-Blutdruckmessungen empfehlen, kennen Sie bereits einige der Funktionen von SaMD. Der SaMD-Markt, der als eigenständige Software definiert ist, die SELBST ein medizinisches Produkt ist, wird voraussichtlich zwischen 2021 und 2027 mit einer CAGR von 11,0 % wachsen und bis 2027 8,2 Milliarden US-Dollar erreichen. Zusammen mit bahnbrechenden Technologien wie AR/VR, KI/ML oder IoT, SaMD hat sich bereits zu einem Game-Changer entwickelt und spielt eine entscheidende Rolle bei der Prävention, Diagnose, Überwachung und Behandlung von Krankheiten. Erlauben Sie uns, das verborgene Potenzial von SaMD aufzudecken!
Was ist SaMD?
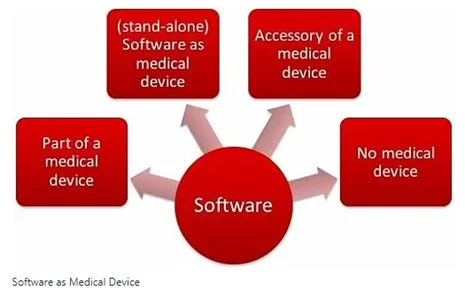
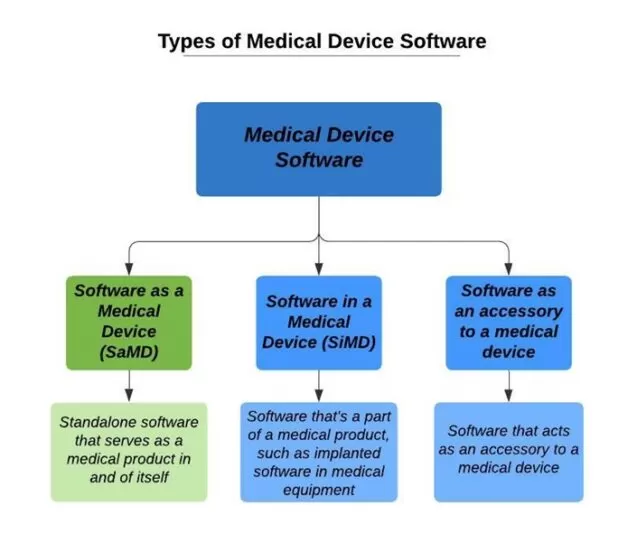
Es gibt verschiedene Arten von Software, die derzeit im Gesundheitswesen verwendet werden. Von EHRs bis hin zu KI-gestützten Überwachungssystemen für chronische Krankheiten kann Software für medizinische Geräte wie folgt klassifiziert werden:
Quelle: Johner-institute
SaMD – eigenständige Software, die selbst ein Medizinprodukt ist und mit nicht-medizinischen Geräten (z. B. Laptops, Smartphones, Smartwatches, Tablets, Desktops usw.)
Beispiele:
- Fruchtbarkeits-Apps: Natural Cycles
- Apps, die die Medikamentendosis in Abhängigkeit vom aktuellen Zustand des Patienten berechnen können (z. B. Diabeteskontrolle – eGlycemic Management System®)
- Apps zur Bildbetrachtung (z. B. MRI, X-Ray etc.): CardioFlux, AIR™ Recon DL
SiMD – handelt es sich um Software IN (=als Teil) eines bestehenden Medizinprodukts
Beispiele:
- Software, die MRT- oder Röntgengeräte betreibt
- Eine mobile App, die kontinuierlich Daten von einem Wearable (z. B. EKG-Monitor, Blutzuckermessgerät usw.)
Allzwecksoftware, die an sich kein Medizinprodukt ist.
Beispiel:
- Eine mobile App für die Kommunikation zwischen Patient und Arzt
- Software, die Daten verschlüsselt, die von einem medizinischen Gerät übertragen werden
Software als Zubehör für medizinische Geräte
Beispiel:
- Software zur Wartung eines Hardware-Medizingeräts
SaMD: Definition und Unterschiede zwischen Softwaretypen
Im Dezember 2013 definierte IMDRF (International Medical Device Regulators Forum) SaMD wie folgt: „Software, die für einen oder mehrere medizinische Zwecke verwendet werden soll, die diese Zwecke erfüllt, ohne Teil einer Hardware zu sein.“ Vereinfacht gesagt ist SaMD ein eigenständiges Medizinprodukt.
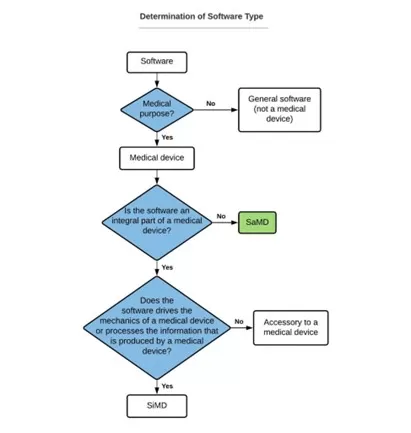
Um die Art der spezifischen Software zu bestimmen, müssen mehrere Fragen beantwortet werden:
Quelle: https: Yan-chia
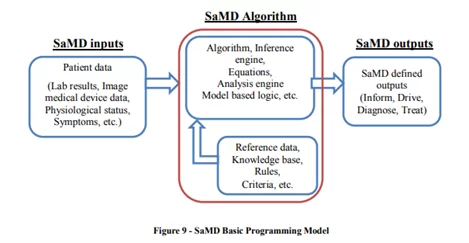
Wie funktioniert SaMD?
Im Jahr 2017 definierte IMDRF den Kontext des klinischen Bewertungsprozesses, der SaMD umfasst. Grundsätzlich verwendet ein SaMD einen Algorithmus, der mit digitalen Daten arbeitet und eine Ausgabe für den vom Hersteller definierten medizinischen Zweck erzeugt:
Zum Beispiel verwendet CAD-Software (computergestützte Erkennung) – wie cmAssist® – einen Algorithmus, der es ihr ermöglicht, Brustkrebs oder Tumore durch Nachbearbeitung und Analyse von Bildern aus mehreren bildgebenden Verfahren (z. B. Mammographie, MRI, CTs, Ultraschall, usw.) CAD-Systeme verwenden Mustererkennungssoftware, mit der sie unbekannte Formen wie Brustmassen, Brustdichte oder Massensegmentierung unterscheiden können.
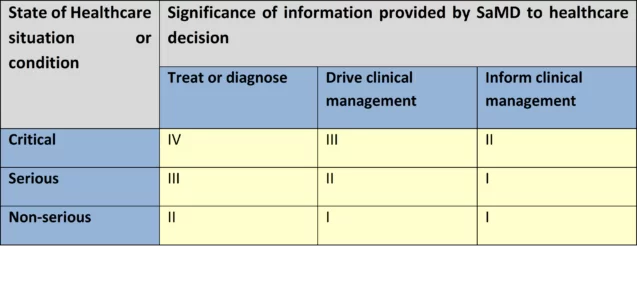
SaMD-Kategorisierung
Basierend auf den Auswirkungen der bereitgestellten Informationen auf die Gesundheit von Patienten/der Öffentlichkeit legt IMDRF vier SaMD-Risikokategorien fest:
Bezüglich der Software-Lebenszyklus-Prozesse legt die Norm IEC 62304 drei zusätzliche Sicherheitsklassen fest:
Klasse A: Es sind keine Verletzungen oder Gesundheitsschäden möglich
Klasse B: Nicht ernsthafte Verletzungen sind möglich
Klasse C: Tod oder schwere Verletzungen sind möglich
Da SaMD personenbezogene Daten sammelt, muss es außerdem GDPR – und HIPAA -konform sein.
SaMD: Marktgröße und Perspektiven
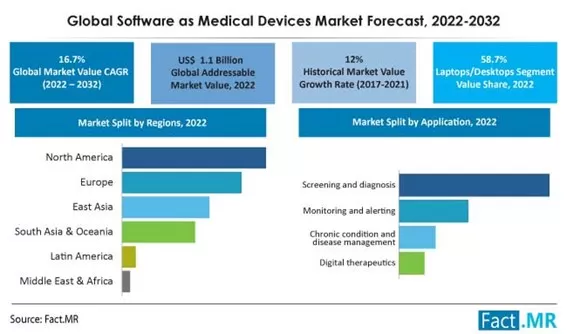
Laut Fact.MR verzeichnete der globale Markt für SaMD zwischen 2017 und 2021 eine CAGR von 12 % und wird zwischen 2022 und 2032 mit einer CAGR von 16,7 % weiter wachsen und eine Bewertung von 5,4 Milliarden US-Dollar erreichen:
Wie von TATA ELXSI hervorgehoben (basierend auf einem Bericht von CB Insights), spielt SaMD bereits eine entscheidende Rolle in weit verbreiteten Bereichen wie klinischen Studien oder Online- und Offline-Spezialversorgung:
Quelle: Yan-chia
Vereinfacht kann SaMD als Unterklasse von Medical Device Software definiert werden.
Software für medizinische Geräte und digitale Therapeutika
Unter dem Dach von Digital Health Solutions können digitale Therapeutika – oder DTx – als regulierte Unterklasse von SaMD definiert werden.
Quelle: Capgemini-engineering
DTx verwendet evidenzbasierte und klinisch evaluierte Software, um Patienten therapeutische Interventionen direkt bereitzustellen. DTx wird verwendet, um eine Vielzahl von Krankheiten wie Alzheimer, Typ-II-Diabetes, Angstzustände, Asthma, ADHS usw. zu verhindern, zu verwalten und zu behandeln. Im Gegensatz zu Fitness- oder Wellness-Apps, die normalerweise nicht reguliert sind und keinen wissenschaftlichen Tests unterzogen werden basiert nicht auf klinischen Beweisen und kann kostenlos heruntergeladen werden, DTx muss strengen Tests unterzogen werden, denselben Standards und Vorschriften entsprechen wie traditionelle medizinische Behandlungen, kann von medizinischem Fachpersonal entweder als eigenständige Behandlung oder in Verbindung mit anderen Medikamenten oder Therapien verschrieben werden und sind erstattungsfähig. Wie der EDSB betonte, ermöglicht DTx den Patienten, ihre Symptome selbst zu bewältigen und die klinischen Ergebnisse und die Lebensqualität zu verbessern. und andere klinische Endpunkte. DTx nutzt digitale Geräte wie Apps, Sensoren, IoT oder VR, um Verhaltensänderungen auszulösen.
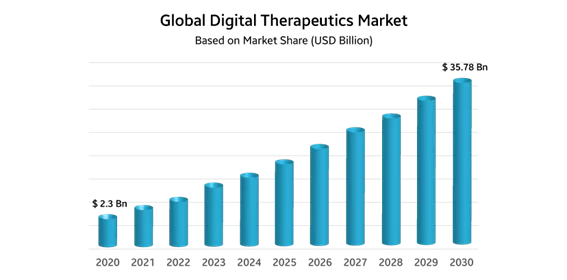
Laut Strategic Market Research wird der globale DTx-Markt bis 2030 voraussichtlich 35,78 Milliarden US-Dollar erreichen und mit einer CAGR von 31,4 % wachsen:
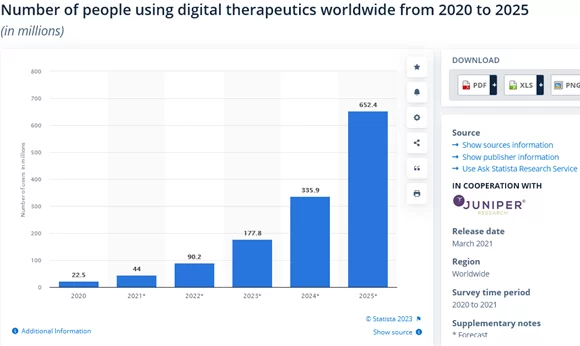
Laut Statista werden bis 2025 voraussichtlich über 652 Millionen Menschen digitale Therapeutika nutzen:
SaMD: Was Sie 2023 wissen müssen
Wir sind gerade in das Jahr 2023 eingetreten und die Zukunft von SaMD sieht weiterhin rosig aus. Um einen konsistenten Wert liefern zu können, muss das Gesundheitswesen ständig neue Technologien, Interoperabilitätsmöglichkeiten, Softwareinnovationen usw. nutzen. Statistiken zeigen, dass SaMD einer der am schnellsten wachsenden Sektoren im digitalen Gesundheitswesen ist, mit Schlüsselakteuren wie Siemens Healthineers (AI -unterstützte Diagnostik, Molekularmedizin, therapeutische Bildgebung usw.), Medtronic (Telemedizin, Diabetesbehandlung, KI-unterstützte Patientenfernüberwachungslösungen usw.) oder MindMaze (digitale Therapie zur Gehirnreparatur), die stark in die Entwicklung von SaMD investieren. Dies sind nur einige Beispiele dafür, wie SaMD bereits die Regeln in der Gesundheitsversorgung neu schreibt.
EU- (Deutschland, Schweiz, Österreich) und US-Regulierungsbestimmungen
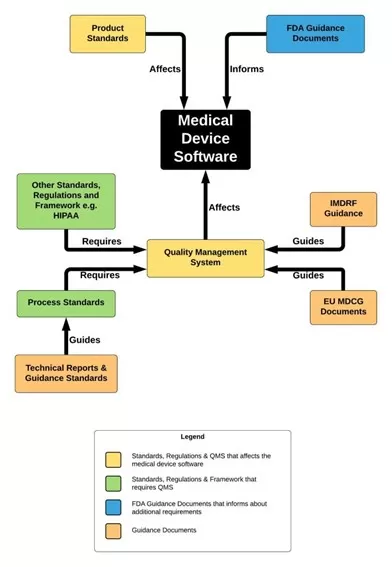
Angesichts der Verbreitung von SaMD im Ökosystem des Gesundheitswesens ist die Arbeit an einem gemeinsamen Regulierungsrahmen zu einer dringenden Notwendigkeit geworden, wodurch das International Medical Device Regulators Forum (IMDRF) ins Leben gerufen wurde. Die vom IMDRF herausgegebenen Leitfäden dienten als Grundlage für die von der EU festgelegten regulatorischen Rahmenbedingungen. und FDA. Yan Chia bietet in ihrem Blog eine Darstellung der Beziehung zwischen relevanten Normen, Vorschriften, technischen Berichten und Leitfäden:
Eine detailliertere Beziehungszuordnung finden Sie in diesem Dokument: https://yanchiacom.files.wordpress.com/2021/11/standards-regulations-and-guidance-documents.pdf
Im Dezember 2019 verabschiedete Deutschland das Digitale-Gesundheits-Gesetz (DVG), das es medizinischem Fachpersonal ermöglicht, allen versicherten Patienten digitale Gesundheitsanwendungen (DiGA) zu verschreiben, die vom BfArM (im „Fast Track“-Verfahren) genehmigt werden. DiGAs sind digitale Medizinprodukte der Klasse I oder IIa, die eine medizinische Funktion haben.
Ähnlich wie in Deutschland und um die Schweizer Gesetzgebung zu Medizinprodukten an die EU-Medizinprodukteverordnung (IVDR und MDR) anzugleichen, hat die Schweiz die Medizinprodukteverordnung (MedV) überarbeitet und eine neue Verordnung, CTO-MedDO(Clinical Trials with Medical Devices) erlassen .)
Da Österreich Teil der Europäischen Union ist, richten sich die Vorschriften für Medizinprodukte nach dem europäischen Rechtsrahmen. Über die Einhaltung dieser Vorschriften wacht das BASG (Österreichisches Bundesamt für Sicherheit im Gesundheitswesen).
Zusammenfassend
Von der Erfindung des Stethoskops im Jahr 1816 bis zur Erfindung des Elektrokardiographen, Herzdefibrillators, der nicht-invasiven fetalen Herzüberwachung, MRT- oder CT-Scannern haben technologische Fortschritte die Medizin kontinuierlich unterstützt und es ihr ermöglicht, sich an neue Realitäten und Anforderungen anzupassen. Da das Gesundheitswesen eine beeindruckende digitale Transformation durchläuft, sind die Möglichkeiten für SaMD praktisch unbegrenzt und markieren einen Wendepunkt in der ML-Analyse, der 3D-Formrekonstruktion, dem Screening, der Krankheitsdiagnose, Überwachung, Behandlung und Prävention.
Haben Sie sich mit dem Thema SAMD auseinandergesetzt und planen Sie die Entwicklung von Software als Medizinprodukt? Achten Sie auf unsere Gesundheitsexpertise. Wir verfügen über ausreichende Kompetenz und helfen bei der Erstellung eines hochwertigen Produkts. Kontaktieren Sie unsere Experten.